A Agência Nacional de Vigilância Sanitária (Anvisa) deu permissão para que a Fundação Hemocentro de Ribeirão Preto (FUNDHERP), em parceria com o Instituto Butantan, comece a realizar um teste médico no Brasil usando um medicamento especial feito a partir de células geneticamente modificadas, chamadas “células CAR-T”, para o tratamento de cânceres que afetam o sangue.
Os estudos estão em uma fase inicial de testes clínicos, chamada Fase 1/2. O objetivo principal é verificar se o tratamento é seguro e eficaz para pessoas com leucemia linfoide aguda B e linfoma não Hodgkin B, especialmente para aqueles cujas doenças voltaram ou que não responderam bem aos tratamentos convencionais.
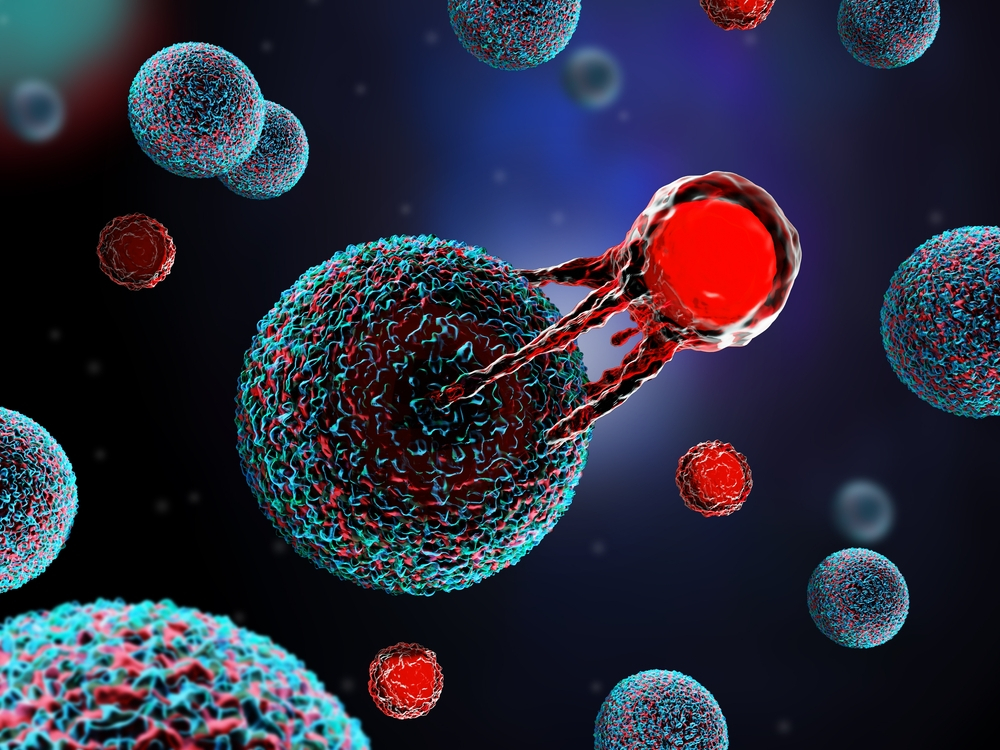
Este tratamento inovador utiliza tecnologia avançada da biotecnologia. Os cientistas brasileiros reprogramam as próprias células de defesa do paciente para atacar e destruir o câncer de forma precisa. Isso é feito em laboratório, onde os genes necessários são transferidos para as células de defesa, chamadas linfócitos T.
Tanto a tecnologia de transferência de genes usando um vetor viral quanto a técnica de produção das células são avanços realizados por pesquisadores brasileiros, com financiamento do governo.
Esse projeto foi possível graças à colaboração entre a Anvisa e os pesquisadores do Sistema Único de Saúde (SUS). A ideia é acelerar o desenvolvimento de terapias avançadas que possam ser disponibilizadas pelo SUS.
A FUNDHERP e o Instituto Butantan foram selecionados para este projeto no início deste ano e receberam um suporte regulatório intensificado para acelerar o processo de desenvolvimento do tratamento.
A Anvisa e os patrocinadores trabalharam em conjunto, com muitas reuniões e discussões técnicas para garantir que o tratamento fosse seguro e eficaz. A rede de especialistas em terapia avançada também contribuiu com a avaliação dos riscos e benefícios.
Após um longo processo de análise documental pela Anvisa e a resolução de exigências pela FUNDHERP, o ensaio clínico foi aprovado. Agora, a Anvisa acompanhará de perto o progresso do tratamento até dezembro de 2024, com o objetivo de disponibilizar a terapia no SUS se os resultados forem positivos.
A Anvisa desempenha um papel importante no apoio ao desenvolvimento de tratamentos inovadores no Brasil, como parte dos esforços do governo para promover a indústria de saúde.
Desde 2020, a Anvisa já registrou três tratamentos de terapia gênica do tipo CAR-T para cânceres e dois para doenças genéticas raras. O Brasil agora faz parte de um grupo seleto de países com regulamentação para esses tratamentos inovadores.
Atualmente, mais de 40 ensaios clínicos com tratamentos experimentais estão ocorrendo no Brasil após a aprovação da Anvisa, incluindo um projeto de terapia gênica desenvolvido por pesquisadores brasileiros para tratar cânceres sanguíneos.
A ciência avança rapidamente para melhorar a vida das pessoas em todo o mundo, e as terapias avançadas, como a terapia gênica e a terapia celular, oferecem esperança para pacientes com doenças graves ou raras que não têm outras opções de tratamento.
No entanto, é crucial que haja regulamentações desde o início do desenvolvimento para garantir que esses tratamentos sejam seguros e eficazes. A colaboração entre pesquisadores e a Anvisa desde o início do processo pode resultar em melhores dados científicos e acelerar o acesso a essas novas tecnologias para as pessoas que precisam delas.
Fonte: Agência Nacional de Vigilância Sanitária – ANVISA







Deixe uma resposta